 Abb. 1: Borrelia burgdorferi
im Dunkelfeldmikroskop (Vergrößerung 400-fach)
Abb. 1: Borrelia burgdorferi
im Dunkelfeldmikroskop (Vergrößerung 400-fach)Lyme-Borreliose - ein neues "Chamäleon" unter den Infektionskrankheiten
Matthias Maiwald
BIOforum 16 (1993) 102-107 - mit freundlicher Genehmigung des Verlags
Die Lyme-Borreliose ist die häufigste zeckenübertragene Erkrankung in Mitteleuropa. Bekannt wurde die Krankheit durch den Ort Lyme in Conneticut, in dem gehäuft Gelenksentzündungen in der Folge von Zeckenstichen auftraten. Erst 1982 wurde der Erreger, ein Bakterium aus der Familie der Spirochaetaceae, von W. Burgdorfer entdeckt. Eine Reihe verschiedener Krankheitsmanifestationen und Symtombilder können im Rahmen einer Lyme-Borreliose entstehen, darunter Erscheinungen an der Haut, am Nervensystem, am Herzen, und an den Gelenken. Die Labordiagnostik der Erkrankung gilt als schwierig, da der Erreger in der Kultur ein anspruchsvolles Wachstumsverhalten zeigt und der Antikörpernachweis, der am häufigsten in der Labordiagnostik angewandt wird, mit Problemen behaftet ist. Molekularbiologische Nachweisverfahren wie die Polymerase-Kettenreaktion (PCR) bedürfen noch einer Evaluierung vor dem Einsatz als diagnostische Routinemethode.
Lyme borreliosis is the most common tick-borne disease in central
Europe. The disease was named after the town of Lyme in Conneticut,
where a cluster of cases of juvenile arthrits after tick bites
had been observed. It was not until 1982 when W. Burgdorfer discovered
the causative agent and showed that it was a bacterium of the
family of Spirochaetaceae. Lyme borreliosis can cause a variety
of disease manifestations and clinical symptoms, involving the
skin, nervous system, heart, and joints. Laboratory diagnosis
is generally considered to be difficult. Culture is not a routine
diagnostic method because of the fastidious growth requirements
of the bacterium. Serology is the most commonly used laboratory
method, but various associated problems can be encountered. Molecular
detection methods such as the polymerase chain reaction (PCR)
need further evaluation before the use as routine diagnostic procedures.
Unter einer nicht zu unterschätzenden Anzahl verschiedener zeckenübertragener Erkrankungen ist in Mitteleuropa die Lyme-Borreliose die häufigste [1, 2]. Erreger der Erkrankung ist Borrelia burgdorferi, ein Bakterium aus der Familie der Spirochaetaceae (Abb. 1). Das Verbreitungsgebiet der Lyme-Borreliose
 Abb. 1: Borrelia burgdorferi
im Dunkelfeldmikroskop (Vergrößerung 400-fach)
Abb. 1: Borrelia burgdorferi
im Dunkelfeldmikroskop (Vergrößerung 400-fach)
erstreckt sich über ganz Mitteleuropa, Nordamerika, Teile Asiens wie China und Japan, sowie Gebiete in Zentralafrika und in Australien [3]. Überträger der Krankheit ist in Europa die Zecke Ixodes ricinus ("gemeiner Holzbock"), in Nordamerika die Zeckenarten Ixodes dammini (Abb. 2), I. scapularis und I. pacificus [4], und in Asien I. persulcatus [5]. Eine weitere in Mitteleuropa vorkommende zeckenübertragene Erkrankung, die virusbedingte Frühsommer- Meningoenzephalitis (FSME), ist ungleich seltener. Ihr Verbreitungsgebiet reicht hauptsächlich von Bayern über Österreich bis in die Balkanländer, sowie Teile der ehemaligen DDR, Polens und Südskandinaviens. Dabei ist bemerkenswert, daß in Endemiegebieten der Lyme-Borreliose etwa jede fünfte Zecke Borrelien enthält, in FSME-Endemiegebieten aber nur jede tausendste Zecke das Virus [3]. Als zusätzliche Überträger der Lyme-Borreliose werden Bremsen und Stechmücken diskutiert.
 Abb. 2: Weibchen der Zecke
Ixodes dammini im Elektronenmikroskop (Vergrößerung
33-fach. Photo: M. Bechtel)
Abb. 2: Weibchen der Zecke
Ixodes dammini im Elektronenmikroskop (Vergrößerung
33-fach. Photo: M. Bechtel)
Entdeckungsgeschichte des Erregers
Symptome der Lyme-Borreliose waren schon lange bekannt vor der Entdeckung des verantwortlichen Erregers. So wurde bereits von Buchwald 1883 eine chronische Hautveränderung beschrieben, die den Namen Acrodermatitis chronica atrophicans erhielt. Im Jahre 1909 entdeckte der schwedische Arzt Afzelius eine nach Zeckenstich aufgetretene, ringförmig wandernde Hautrötung, die den Namen Erythema migrans erhielt. Neurologische Symptome nach Zeckenstich wurden 1922 von den französischen Forschern Garin und Bujadoux und 1941 von dem Münchner Neurologen Bannwarth beschrieben. Eine ungewöhnliche Häufung von Gelenksbeschwerden in der Umgebung des amerikanischen Ortes Lyme in Conneticut führte zu einer systematischen Untersuchung durch den Epidemiologen A. Steere, der 1977 die ""Lyme Disease" als bisher vermeintlich unbekannte, systemische Erkrankung in der Folge von Zeckenstichen beschrieb [6]. Erst 1982 fand W. Burgdorfer auf der Suche nach den ebenfalls zeckenübertragenen Rickettsien im Mitteldarm von Zecken Spirochäten, schraubenförmige Bakterien, von denen gezeigt werden konnte, daß sie mit Seren von Patienten mit Lyme Disease reagierten und somit die Ursache der Erkrankung sein mußten [7]. In der Folge nahm die Charakterisierung des Erregers, die Erfassung seiner Verbreitung, sowie die Beschreibung immer neuer klinischer Erscheinungen einen stürmischen Verlauf, so daß mittlerweile die Lyme-Borreliose eine der am intensivsten bearbeiteten bakteriellen Infektionskrankheiten ist.
Der klinische Verlauf der Erkrankung läßt sich prinzipiell in drei Stadien einteilen, ähnlich wie bei der Syphilis, die früher als das Chamäleon der inneren Medizin galt; dabei können einzelne Stadien übersprungen werden oder aber in jedem der Stadien eine spontane Ausheilung erfolgen. Als erste Erscheinung der Erkrankung bildet sich mehrere Tage bis wenige Wochen nach Zeckenstich um die Stichstelle herum eine sich ringförmig ausbreitende Hautrötung, das Erythema chronicum migrans (Abb. 3), das von unspezifischen Allgemeinsymptomen wie Müdigkeit, Fieber oder Gliederschmerzen begleitet sein kann.
 Abb. 3: Erythema migrans
im Nacken (Photo: D. Hassler)
Abb. 3: Erythema migrans
im Nacken (Photo: D. Hassler)
Dieses Erythem, charakteristisch für das Vorliegen einer Lyme-Erkrankung, wird allerdings nur in etwa 40-60% der Fälle beobachtet, so daß bei Fällen vermuteter, aber nicht sicherer Zweit- oder Drittstadiumborreliose der fehlende Hinweis auf ein Erythema migrans die Diagnose nicht ausschließt. Nach einer Erregergeneralisation folgt das zweite Stadium der Erkrankung, welches wenige Wochen bis Monate nach Zeckenstich beginnt und mit neurologischen Symptomen, Herzsymptomen, Augenmanifestationen oder unspezifischen Allgemeinbeschwerden einhergehen kann. Als neurologische Symptome können Meningitis, Hirnnervenlähmungen, sowie Schmerzen und Empfindungsstörungen entlang peripherer Nerven auftreten. Häufiges neurologisches Symptom ist die Gesichtsnervenlähmung (Facialisparese). Am Herzen kann es im Rahmen einer Zweitstadiumborreliose zu Überleitungsstörungen kommen (AV-Block 1. bis 3. Grades), die die Implantation eines temporären Schrittmachers erforderlich machen können. Das dritte Stadium der Erkrankung, Monate bis Jahre nach Zeckenstich, geht häufig mit Gelenksbeschwerden einher. Als "typisch" gelten hier von Gelenk zu Gelenk springende Arthritiden, häufig begleitet von Allgemeinsymptomen. Dabei wird das Kniegelenk bevorzugt betroffen. Hautmanifestation des dritten Stadiums ist die Acrodermatitis chronica atrophicans (Abb. 4), beginnend als Schwellung und bräunliche Verfärbung der Haut an den betroffenen Stellen (häufig Hände und Streckseiten der Unterarme und Unterschenkel), später übergehend in ein atrophisches Stadium mit zigarettenpapierdünner, gefältelter Haut. Als neurologische Erkrankung kann es im späten Stadium der Borreliose zu einer chronischen Enzephalitis kommen, die in seltenen Fällen sogar mit psychiatrischen Symptomen (z. B. Wahnvorstellungen) einhergehen kann.
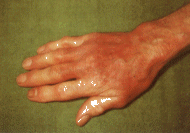 Abb. 4: Acrodermatitis
chronica atrophicans an der Hand (Photo: D. Hassler)
Abb. 4: Acrodermatitis
chronica atrophicans an der Hand (Photo: D. Hassler)
Da die kulturelle Anzucht des Erregers als schwierig und unzuverlässig gilt, bleibt sie Speziallaboratorien vorbehalten. Dennoch beweist die Kultur im positiven Fall die Diagnose, da ihr eine praktisch hundertprozentige Spezifität zukommt. Da B. burgdorferi höchste Ansprüche an die Zusammensetzung des Nährmediums stellt, ist eine sorgfältige Auswahl der Mediumbestandteile und eine sorgfältige Zubereitung unumgänglich. Die hierbei verwendeten Medien basieren auf einem Rezept, das von Kelly [8] für die Kultivierung von Borrelia hermsii, einer verwandten Borrelienart entwickelt wurde. Am häufigsten wird BSK II-Medium (Barbour-Stoenner-Kelly-Medium) verwendet [9]. Unter Verwendung optimierter Kulturtechniken gelingt die Anzucht des Erregers aus Hautbiopsien bei Erythema migrans oder Acrodermatitis chronica atrophicans relativ häufig (ca. 40-50% der Fälle), aus anderen Materialien wie Liquor oder Citratblut dagegen selten [10].
Die weitaus am häufigsten angewandte Labordiagnostik ist demnach der Nachweis von Antikörpern gegen B. burgdorferi aus Serum oder Liquor des Patienten. Serologische Standardtests sind Immunfluoreszenztest (IFT) unter Verwendung gesamter Borrelien als Testantigen oder Enzym-Immuno-Assay (EIA) unter Verwendung von Borrelien, die durch Ultraschallbehandlung lysiert wurden. Auch der indirekte Hämagglutinationstest (IHA) wird eingesetzt. Bis auf den IHA werden diese Tests getrennt zur Bestimmung von Antikörpern der Klassen IgM und IgG durchgeführt. Dabei ist die Serologie mit Problemen behaftet, beispielsweise reagieren nur etwa 20-50% der Patienten im Stadium I und etwa 70-90% der Patienten im Stadium II serologisch positiv, da die Immunantwort auf den Erreger häufig verzögert einsetzt [10]. Im Spätstadium der Erkrankung sind in der Regel hohe Antiköpertiter nachweisbar und somit kaum Probleme mit falsch negativen Testergebnissen zu erwarten. Da B. burgdorferi eine Reihe von Antigenstrukturen besitzt, die Gemeinsamkeiten mit denen anderer Erreger haben ("common antigens"), können jedoch falsch positive serologische Befunde vorkommen. Einige Laboratorien führen daher zur Vermeidung von Kreuzreaktionen mit anderen "common antigens" eine Vorabsorption der Patientenseren mit Reiterspirochätenextrakt durch. Dieser besteht aus einem ultraschallbehandelten Extrakt von Treponema phagedenis, einem Bakterium, das ebenso wie B. burgdorferi aus der Familie der Spirochaetaceae stammt. Hiermit sollen kreuzreagierende Antikörper aus dem Patientenserum entfernt werden und nur die spezifisch gegen B. burgdorferi gerichteten Antikörper übrig bleiben. Allerdings kann es dann dazu kommen, daß die ohnehin schwache Immunantwort in frühen Stadien der Erkrankung unter den Grenzwert des Tests fällt. Daher ist zur Diagnosestellung einer Lyme-Borreliose häufig eine sorgfältige Erwägung von Anamnese, klinischem und serologischem Befund erforderlich, keinesfalls sollte die Serologie als ausschließliches diagnostisches Kriterium eingesetzt werden.
Ebenso wie die Erkrankung selbst folgt auch die Immunantwort des Körpers einem stadienähnlichen Verlauf. Werden die Antigene von B. burgdorferi mittels Polyacrylamidgel- Elektrophorese aufgetrennt (Abb. 5), auf eine Nitrozellulosemembran übertragen und anschließend die Reaktion des Patientenserums gegen einzelne antigen wirksame Proteine des Erregers untersucht, dann finden sich zu verschiedenen Krankheitsstadien auch verschiedene Reaktionsmuster. Mittels dieses Verfahrens, bekannt als Westernblot, konnte die Rolle der wichtigsten antigenen Bestandteile des Erregers aufgeklärt werden. Somit richtet sich die Immunantwort in frühen Stadien der Erkrankung vorwiegend gegen das 41kD-Protein (Flagellin oder Geißelantigen), sowie gegen das 21kD-Protein, auch bekannt als "pC" [10]. Dabei besitzt das 41kD-Antigen auch Anteile, die Gemeinsamkeiten mit den Flagellen-Antigenen anderer Bakterien aufweisen, so daß auch manche Seren von Personen ohne Lyme-Borreliose mit dem 41kD-Antigen reagieren. Das 21kD-Protein weist zwar keine solchen Kreuzreaktionen auf, jedoch gibt es Patienten mit Borreliose, die keine Immunantwort gegen das Protein ausbilden. Ferner zu erwähnen ist das 60kD-Protein, das zur Gruppe der sogenannten "heat shock"-Proteine zählt und viele Kreuzreaktionen zu anderen Bakterien aufweist. Gegen die beiden Oberflächenproteine OSP A (ca. 31kD) und OSP B (ca. 34kD) werden, obwohl sie auf der äußeren Membran lokalisiert sind, nur von sehr wenigen Patienten Antikörper gebildet, so daß eine Immunreaktion gegen diese Bestandteile nur im positiven Fall Aussagekraft besitzt. Für die Diagnostik von Spätstadium-Infektionen ist das 94kD-Protein (100kD-range protein) besonders gut geeignet. Eine Immunreaktion gegen dieses Protein entsteht zwar in der Regel erst spät im Verlauf der Erkrankung, es weist aber keine bekannten Kreuzreaktionen auf und gilt daher als diagnostisch unzweifelhaft. Neben den genannten Antigenen gibt es mehrere andere, die von einigen Arbeitsgruppen propagiert wurden, aber deren diagnostische Bedeutung noch nicht allgemein anerkannt ist. Der Westernblot in der Borreliosediagnostik ist aber nicht als universeller Bestätigungstest wie in der HIV-Diagnostik geeignet, da bislang keine standardisierten Bewertungskriterien vorliegen und es Fälle im frühen Stadium der Erkrankung gibt, bei denen auch mit Hilfe des Westernblots keine Diagnosesicherung möglich ist. Einige der oben angeführten Antigene werden in gereinigter Form als Einzelantigene in serologischen Tests eingesetzt. Dabei besteht die Möglichkeit, die Antigene auf physikalischem Wege aufzureinigen, zum Beispiel über isoelektrische Fokussierung oder Extraktion mittels Detergentien, oder aber die Proteine in rekombinanter Form herzustellen, also auf gentechnologische Weise in geeigneten Bakterienstämmen zu vervielfältigen. Mit Hilfe eines physikalisch gereinigten Flagellins konnte bereits eine deutliche Verbesserung der Sensitivität und Spezifität gegenüber Borrelien- Gesamtantigen erzielt werden [11]. Rekombinante Antigene werden derzeit von verschiedenen Arbeitsgruppen auf ihre diagnostische Einsetzbarkeit überprüft, jedoch gelten prinzipiell die erwähnten Vor- und Nachteile der im Westernblot getesteten Antigene auch bei der Verwendung als rekombinante Antigene. Es ist derzeit Stand der Diskussion, ob sich durch die Verwendung eines Gemisches mehrerer rekombinanter Testantigene eine Verbesserung der Serodiagnostik erzielen läßt.
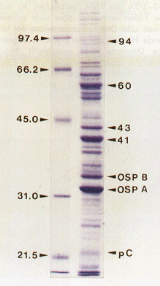 Abb. 5: Polyacrylamidgelektrophorese
der Proteine von B. burgdorferi. Linke Spur: Molekulargewichtsmarker,
rechte Spur: B. burgdorferi. Molekulargewichte in Kilodalton (kDa).
Abb. 5: Polyacrylamidgelektrophorese
der Proteine von B. burgdorferi. Linke Spur: Molekulargewichtsmarker,
rechte Spur: B. burgdorferi. Molekulargewichte in Kilodalton (kDa).
Es gibt inzwischen mehrere Berichte über den Direktnachweis von Borrelienantigenen im Urin mittels Enzymimmunoassay oder Blottingtechniken. Da jedoch Sensitivität und Spezifität der Urin-Antigennachweise als noch nicht ausreichend abgesichert gilt, ist das Anwendungsgebiet des Verfahrens derzeit noch eingeschränkt. Eine weitere, vielversprechende Technik zum Direktnachweis von Erregern ist die Polymerase-Kettenreaktion (PCR). Dabei werden DNA-Sequenzen des Erregers auf enzymatischem Wege mittels einer thermostabilen DNA-Polymerase vervielfältigt, so daß nach Anwendung des Verfahrens von einem ausgesuchten DNA-Fragment eine Vielzahl von Kopien vorliegt. Diese Kopien lassen sich dann mittels konventioneller Techniken nachweisen. Auf diese Weise gelingt theoretisch der Nachweis der DNA eines einzelnen Erregers im Reaktionsansatz. Dieses Verfahren ist besonders attraktiv für Erreger, die sich nicht oder schlecht anzüchten lassen und umgeht im vorliegenden Fall die schwierige Kultivierbarkeit der Borrelien aus Untersuchungsmaterial. Für B. burgdorferi steht allerdings eine umfassende klinische Erprobung des Verfahrens noch aus. Kritische Punkte sind hier die Auswahl der zur Diagnostik verwendeten Untersuchungsmaterialien und die Auswahl des geeigneten Probenvorbereitungsverfahrens vor der enzymatischen Vervielfältigung. Materialien, über deren Verwendung in der PCR berichtet wurde, sind Zecken, Hautbiopsien, Blut- und Urinproben, Liquor und Gelenkspunktate. Unklar ist derzeit, in welchen Untersuchungsmaterialien bei Vorliegen der Erkrankung regelmäßig mit der Anwesenheit von Borrelien-DNA gerechnet werden kann. Die PCR ist jedoch eine in schneller Entwicklung begriffene Methode und wird das diagnostische Spektrum für die Lyme-Borreliose entscheidend bereichern.
Borrelieninfektionen sind prinzipiell in jedem Stadium einer Therapie mit Antibiotika zugänglich. Lange vor der Entdeckung des Erregers war bekannt, daß verschiedene Krankheitserscheinungen, die man später als Symptome der Lyme-Borreliose zuordnen konnte, ein gutes Ansprechen auf Antibiotika zeigten. In-vitro-Untersuchungen nach erfolgter Kultivierung des Erregers zeigten, daß Penicillin G eine mäßige, andere Antibiotika wie Tetracycline, Amoxicillin, Erythromycin, Cefotaxim und Ceftriaxon eine gute Aktivität gegen B. burgdorferi aufwiesen [12, 13]. In Tierversuchen bestätigten sich die in vitro-Ergebnisse, mit Ausnahme des Erythromycins, welches in vivo nur eine mäßige Aktivität aufwies [13]. Klinische Studien gaben weitere Hinweise auf eine verbesserte Wirksamkeit von Cefotaxim oder Ceftriaxon gegenüber Penicillin G im Spätstadium der Erkrankung [14, 15]. Die Therapie einer Lyme-Borreliose sollte sich nach dem Stadium der Erkrankung und dem Schweregrad der Symptome richten. Bei Vorliegen eines Erythema migrans ist in der Regel eine etwa 14 tägige orale Therapie (Doxicyclin, bei Kindern Amoxycillin) ausreichend. Im zweiten oder dritten Stadium sollte eine zwei- bis dreiwöchige intravenöse Therapie mit Cefotaxim oder Ceftriaxon erfolgen. Ausweichmedikamente, zum Beispiel bei Allergien, sind Doxicyclin, Imipenem, oder Erythromycin.
Der Informationsbedarf bei Patienten in Bezug auf die Sicherung der Diagnose und die Bedürfigkeit einer Antibiotikatherapie ist dabei enorm; immer wieder gibt es Patienten mit uncharakteristischen Symptomen, die auch Symptome einer Lyme-Borreliose sein können. Aufgrund eines positiven Ergebnisses in der Borrelienserologie sind diese Patienten der festen Überzeugung, eine Borrelieninfektion zu haben und suchen oft mehrere Ärzte auf mit dem Wunsch nach einer Antibiotikatherapie.
Eine gute Präventionsmöglichkeit stellt die frühzeitige Entdeckung und Entfernung der Zecke dar. Eine Untersuchung an Hamstern und Mäusen konnte zeigen, daß die Übertragung von B. burgdorferi signifikant von der Dauer des Saugaktes der Zecke abhängt. Eine Übertragung fand nur in einem von 14 Tieren statt, an denen die Zecken 24 Stunden gesaugt hatten, dagegen fand eine Übertragung in 13 von 14 Tieren statt, die für 72 Stunden oder länger Zecken an sich hatten [16]. Für den Menschen ist jedoch das individuelle Risiko einer Übertragung des Erregers oder einer Erkrankung nach dem Stich einer infizierten Zecke noch weitgehend unbekannt. Eine prophylaktische Antibiotikatherapie nach alleinigem Vorliegen eines Zeckenstichs wird allerdings von der überwiegenden Mehrzahl der Experten abgelehnt. Eine Impfung gegen B. burgdorferi ist noch nicht erhältlich. Die von Patienten häufig angesprochene "Zeckenimpfung" bezieht sich auf das Virus der Frühsommer-Meningoenzepalitis (FSME). Eine Arbeitsgruppe vom Freiburger Institut für Immunbiologie [17] hat Ansätze für eine mögliche Impfstoffentwicklung gegen B. burgdorferi gefunden. Dabei konnte ein Stamm von Mäusen mit schwerer kombinierter Immundefizienz (severe combined immunodeficiency) durch die Gabe von Antikörpern gegen das Outer Surface Protein A (OSP A) von B. burgdorferi vor einer Infektion geschützt werden. Somit handelt es sich beim OSP A um ein Protein, das eine Bildung von Antikörpern mit Schutzwirkung induzieren kann. Unklar ist allerdings, warum bei der natürlich auftretenden Borrelieninfektion im Menschen nur ein geringer Prozentsatz der Patienten eine Immunantwort gegen OSP A ausbildet. Solche und andere Fragen müssen geklärt werden, bevor ein möglicher Impfstoff Anwendung am Menschen finden kann.
[1] WILSKE, B., R. STEINHUBER, H. BERGMEISTER,
V. FINGERLE, G. SCHIERZ, V. PREAC-MURSIC, E. VANEK, B. LORBEER:
Lyme-Borreliose in Süddeutschland. Dtsch. med. Wschr. 112,
1730-1736 (1987)
[2] WILSKE, B., V. PREAC-MURSIC, G. SCHIERZ, G: Lyme-Borreliose.
Die gelben Hefte 28, 136-145 (1988)
[3] STANEK, G.: Bemerkungen zur Epidemiologie der Lyme-Borreliose.
In: EINHÄUPL, K.M., K. FELGENHAUER, P. HERZER, G. STIERNSTEDT:
Lyme-Borreliose. Symposium Eibsee 6. und 7. September 1989. Editiones
Roche, Grenzach-Wyhlen, 1989
[4] ANDERSON, J.: Epizoology of Lyme borreliosis. Scand. J. Infect.
Dis., Suppl. 77, 23-34 (1991)
[5] CHENGXU, A., W. YUXIN, Z. YONGGUO, W. SHAOSHAN, Q. QUICHENG,
S. ZHIXUE, L. DEYOU, C. DONGQUAN, L. XIAODONG, Z. JIENHUA: Clinical
manifestations and epidemiological characteristics of Lyme disease
in Hailin County, Heilongjiang province, China. Ann. N. Y. Acad.
Sci. 539, 302-313 (1988)
[6] STEERE, A.C., S. E. MALAWISTA, D. R. SNYDMAN: Lyme arthritis:
an epidemic of oligoarticular arthritis in children and adults
in three Conneticut communities. Arthritis Rheum. 20, 7-17 (1977)
[7] BURGDORFER, W., A. G. BARBOUR, S. F. HAYES, J. L. BENACH,
E. GRUNWALDT, J. P DAVIS: Lyme disease - a tick borne spirochetosis?
Science 216, 1317-9 (1982)
[8] KELLY, R.: Cultivation of Borrelia hermsii. Science 173, 443-444
(1971)
[9] BARBOUR, A.: Isolation and cultivation of Lyme Disease spirochetes.
Yale J. Biol. Med. 57, 521-525 (1984)
[10] WILSKE, B., V. PREAC-MURSIC, R. FUCHS, G. SCHIERZ: Diagnostik
der Lyme-Borreliose. Die gelben Hefte 40, 24-36 (1990)
[11] HANSEN, K., P. HINDERSSON, N. S. PEDERSEN: Measurement of
antibodies to the Borrelia burgdorferi flagellum improves serodiagnosis
in Lyme disease. J. Clin. Microbiol. 26, 338-346 (1988)
[12] JOHNSON, R. C., C. KODNER, M. RUSSEL: In vitro and in vivo
susceptibility of the Lyme disease spirochete, Borrelia burgdorferi,
to four antimicrobial agents. Antimicrobial Agents and Chemotherapy
31, 164-167 (1987)
[13] PREAC-MURSIC, V.: Bakteriologische Diagnostik der Lyme-Borreliose,
in-vitro- und in-vivo- Empfindlichkeit des Erregers Borrelia burgdorferi.
In: Einhäupl, K.M., K. Felgenhauer, P. Herzer, G. Stiernstedt:
Lyme-Borreliose. Symposium Eibsee 6. und 7. September 1989. Editiones
Roche, Grenzach-Wyhlen, 1989
[14] DATTWYLER, R. J., J. J. HALPERIN, D. J. VOLKMAN, B. J. LUFT:
Treatment of late Lyme borreliosis- randomized comparison of ceftriaxone
and penicilline. Lancet ii, 1191-1194 (1988)
[15] HASSLER, D., L. ZÖLLER, M. HAUDE, H.-D. HUFNAGEL, F.
HEINRICH, H.-G. SONNTAG: Cefotaxime versus penicillin in the late
stage of Lyme disease - prospective, randomized therapeutic study.
Infection 18, 16-20 (1990)
[16] PIESMAN, J., T. N. MATHER, R. J. SINSKY, A. SPIELMAN: Duration
of tick attachment and Borrelia burgdorferi transmission. J. Clin.
Microbiol. 25, 557-558 (1987)
[17] SIMON, M. M., U. E. SCHAIBLE, R. WALLICH, M. D. KRAMER: A
mouse model for Borrelia burgdorferi infection: approach to a
vaccine against Lyme disease. Immunology Today 12: 11-16 (1991)