entnommen: Priv. Doz. Dr. D. Hassler, http://www.dieterhassler.de
4.1 Lokale Infektion: Das Stadium I
4.2 Der Erreger wird gestreut: Das Stadium II
4.3 Unglaubliche Symptomvielfalt
4.4 Latente Neuroborreliose
4.5 Der Erreger setzt sich fest: Das chronische Stadium III
4.6 Borreliose in der Schwangerschaft
4.7 Übertragung durch Blut?
4.8 Krebs durch Borrelien?
4.9 Wie machen Borrelien krank?
5.1 Serologische Diagnostik
5.2 Gibt es "seronegative" Borreliosen?
5.3 Direktnachweis von Borrelienantigenen mittels PCR
5.4 Serologische Therapiekontrolle
5.5 Mikrobiologische Verfahren
6.1 Empfehlungen zur Therapie
6.2 Gibt es Borreliosen, die nicht mehr therapierbar sind?
6.3 Therapieprobleme
6.4 Kontrolle und Nachsorge
6.5 Prophylaxe
7.1 Allgemeine Übersichtsliteratur
7.2 Spezielle Literatur
7.3 Postskriptum: Das "Allerletzte" zum Thema
Die Erreger der Lyme-Borreliose, die Bakterien Borrelia burgdorferi, Borrelia garinii und Borrelia afzelii sind mit dem Syphiliserreger Treponema pallidum eng verwandt. Zwischen beiden Krankheiten, der Lyme-Borreliose und der Syphilis, bestehen daher zahlreiche Parallelen. Es existieren mehrere Krankheitsstadien, die fließend ineinander übergehen oder auch durch sehr lange beschwerdefreie Intervalle getrennt sein können. Diese "sekundären Latenzstadien" gehören zu den besonderen Charakteristika der Borreliose.
Die drei Borrelienarten B. burgdorferi, B. garinii und B. afzelii wurden kürzlich aufgrund genetischer Unterschiede getrennt. Ob sie, wie von einigen Autoren vermutet, sich in ihrer Krankheitswirkung unterscheiden, bedarf noch der Klärung. Angeblich verursacht B. garinii mehr Neuroborreliosen und B. afzelii mehr Hautmanifestationen.
Die Borreliose wird praktisch immer von Zecken übertragen (in Europa von Ixodes ricinus, in Amerika von Ixodes dammini und Ixodes pacificus, in Ostasien von Ixodes persulcatus). Andere Übertragungswege wurden zwar diskutiert (beispielsweise durch den "Wadenstecher", eine in der Nähe von Viehweiden häufigen, stechenden Fliegenart), sind bisher aber nicht gesichert. Eine sexuelle Übertragung wie bei der Syphilis existiert nicht.
Leider wird die Borreliose auch heute noch mit der ebenfalls von Zecken übertragenen Frühsommer-Meningo-Enzephalitis (FSME) verwechselt. Die FSME ist eine Erkrankung, die durch ein Flavivirus hervorgerufen wird.
Diese Erkrankung kommt nur in bestimmten Endemiegebieten Mitteleurpoas vor und ist im Gegensatz zur Borreliose nicht flächendeckend verbreitet. Hauptendemiegebiete sind Bayern (hier besonders der Raum Regensburg), Österreich (weitverbreitet, auch etwa am Plattensee) und Baden-Württemberg. Hier ist vor allem ein Gürtel von Tübingen über Weil der Stadt, Pforzheim, Langensteinbach, die Schwarzwaldtäler bis zum Raum Freiburg betroffen. Im Kraichgau und in den höchsten Lagen des Schwarzwaldes (über 1000 m) fehlt sie. Im Odenwald gibt es bisher vereinzelte Erkrankungsfälle (Wilhelmsfeld, Weinheim). In der gesamten Bundesrepublik erkranken jährlich etwa 200-250 Menschen, hingegen an Borreliose ca. 50 000 - 100 000 pro Jahr!.
Gegen die FSME kann man im Gegensatz zur Borreliose aktiv und damit vorbeugend impfen. Die FSME-Impfung (nicht "Zecken"-Impfung!) ist gut verträglich und allen gefährdeten Personen in Endemiegebieten zu empfehlen, da nach einer einmal erfolgten Infektion keine Therapie mehr möglich ist und die FSME zu bleibenden schweren Lähmungen führen kann (5-10 %).
Die meisten Fälle der FSME verlaufen aber relativ gutartig. Die Krankheit beginnt etwa 2 Wochen nach Zeckenstich mit grippeartigen Symptomen, eine weitere Woche später treten erste Nervenentzündungen oder Lähmungen auf. Ist das Zentralnervensystem (Gehirn) betroffen, können bleibende Schäden folgen.
Die Lyme-Borreliose ist praktisch weltweit verbreitet. Es gibt inzwischen Berichte aus fast allen Teilen der Erde inclusive Australien, Südafrika und China. Temperaturgrenzen wie bei der Viruskrankheit FSME, die sich nicht über Gebiete mit einer mittleren Jahrestemperatur von mindestens 8° C hinaus erstreckt, existieren nicht. Borrelien kommen sogar im Eismeer (Spitzbergen und Jan Mayen) vor, wo sie in Seevögeln nachgewiesen wurden, die von einer speziellen Zeckenart, Ixodes uriae, befallen werden.
Heute wissen wir, daß in Mitteleuropa fast alle Gebiete mehr oder minder zum Verbreitungsgebiet der Borreliose gehören, wobei regionale Schwerpunkte bestehen. Jedes Jahr erkranken in Deutschland 0,5 % der Bevölkerung neu!
In dem von uns schwerpunktmäßig untersuchten Gebiet Kraichgau in Nordbaden sind etwa 17% der Bevölkerung seropositiv, d. h. es lassen sich in deren Blut Antikörper gegen Borreliose nachweisen. Die meisten dieser seropositiven Patienten haben auch charakteristische Beschwerden. Durch eine prospektive Untersuchung des Kollektivs über einen Zeitraum von fast zehn Jahren konnten wir zeigen, daß die jährliche Rate von Neuerkrankungen ("Inzidenz") etwa 0,5% der Bevölkerung beträgt [10].
Manche der Krankheitsmanifestationen, wie die Acrodermatitis chronica atrophicans (ACA) [siehe Seite 8], sind seit dem letzten Jahrhundert in Europa bekannt. Die ersten Berichte über die ACA stammen von Buchwald 1883 und von Touton 1886. Wenig später wurden die ersten amerikanischen Fallberichte von Elliot 1894 und Bronson 1895 veröffentlicht. Bereits in den dreißiger Jahren wurde von Sweitzer auch über in Amerika geborene Patienten mit einer ACA berichtet. Die Borreliose ist also keineswegs eine neue Krankheit. Da aber die verschiedenartigen Symptome, die im Rahmen einer Borrelien-Infektion auftreten können, nicht als ein einheitliches Krankheitsbild erkannt worden war, war über Jahrzehnte die Bedeutung der Borreliose als Krankheitseinheit unbekannt.
Viele an Borreliose erkrankte Personen erinnern sich nicht an einen Zeckenstich. Das liegt einmal an der Tatsache, daß der Infektionsbeginn lange zurückliegen kann, und andererseits daran, daß die Zeckenlarven und -nymphen so klein sind, daß sie oft unbemerkt bleiben. Die 0,8 - 1mm großen Zeckenlarven können aber Borrelien übertragen, da sie selbst schon transovariell infiziert sein können [56]. Die Larven sind zu etwa 1 - 3 % infiziert, das nächste Stadium, die Nymphe, zu etwa 20 %.
4.1 Lokale Infektion: Das Stadium I
Nach der Übertragung der Borrelien durch den Zeckenstich kommt es zunächst zu einer lokalen Infektion der Haut. Ein klassisches Erythema migrans ("Wanderröte", eine normalerweise ringförmige Rötung, die kaum Beschwerden verursacht) wird nur in etwa der Hälfte der Fälle beobachtet. Es verschwindet mitunter auch ohne Therapie, kann aber Monate lang bestehen und dehnt sich meist langsam von der Stichstelle in die Umgebung aus. Wenn aber die Zecke beim Stich ein Blut- oder Lymphgefäß trifft, so kann es zu einer direkten Streuung über das Blut oder die Lymphflüssigkeit kommen. Dann kann das Erythema migrans fehlen und die Krankheit beginnt wenige Tage nach dem Stich mit grippeähnlichen Allgemeinsymptomen (siehe unten).
Wenn bereits im Stadium des Erythema migrans Allgemeinsymptome (Schweiß-ausbrüche, Abgeschlagenheit, Grippegefühl, Herzklopfen) auftreten, ist dies als Zeichen einer Erregerstreuung zu werten und markiert den Übergang ins klinische Stadium II. Nun ist also der Erreger nicht mehr auf den Ort der Lokalinfektion begrenzt, sondern kann sich überall im Körper befinden! Im Tierversuch waren die Borrelien zum Teil schon Stunden nach Infektionsbegin im Liquor nachweisbar (Literatur: Garcia-Monco).
4.2 Der Erreger wird gestreut: Das Stadium II
Meist kommt es nach einer Latenzzeit von bis zu zehn Wochen zur Streuung des Erregers über die Blut- oder Lymphbahn. Dadurch treten dann die zitierten Allgemeinsymptome wie Abgeschlagenheit, Nachtschweiß, Fieber, Muskel- und Gelenkschmerzen und bisweilen auch eine deutliche Gewichtsabnahme auf. Manchmal wird auch Haarausfall beobachtet. Die Patienten berichten über eine oft unerträgliche Müdigkeit, Konzentrationsprobleme und Schwindelattacken. Besonders charakteristisch sind extreme Schweißausbrüche (die Patienten ziehen sich nachts um, weil sie durchgeschwitzt sind) und Episoden mit unangenehmen Empfindungen durch einen schnellen und als heftig empfundenen Pulsschlag.
In seltenen Fällen werden polytope Erytheme ("Wanderröte" an mehreren Körperstellen) beobachtet. Es soll dies in Amerika häufiger als in Europa vorkommen. In einem solchen Fall ist zwingend von einer Erregerstreuung über die Blutbahn auszugehen.
4.3 Unglaubliche Symptomvielfalt
Nach der Erregergeneralisation kommt es zu ersten Organsymptomen: Entzündliche Vorgänge an peripheren Nerven (Neuritiden) verursachen pseudo-radikuläre Syndrome mit oft unerträglichen Schmerzen. Der Schmerzcharakter und die neurologischen Defizite einer Borrelienneuritis können einen Bandscheibenvorfall imitieren. Das Schmerzmaximum ist oft nachts, Belastung verschlimmert die Schmerzen. Übliche Schmerzmittel und nicht-steroidale Antiphlogistika wie Diclofenac ("Voltaren") helfen fast nicht.
Sensorische Störungen ("Ameisenlaufen", Temperatursensationen mit Hitze- oder Kältegefühl) sind sehr häufig, motorische Ausfälle (Lähmungen) ausgesprochen selten. Häufig kommt es zu neurologischen Störungen, die an ein Carpaltunnelsyndrom denken lassen, was gelegentlich auch zur Operation der betreffenden Patienten führt.
Manchmal kommt es zu Hirnnervenausfällen, am häufigsten zur peripheren Facialisparese (Gesichtslähmung). Aber auch andere Hirnnerven wie Abducens, Statoacusticus oder Olfactorius können betroffen sein. Die Häufigkeit von Facialisparesen wird aber krass überbewertet, weil in vielen Fällen erst die Facialisparese Anlaß ist, an eine Borreliose zu denken.
Kappenförmige, vom Nacken ausstrahlende Kopfschmerzen, Schwindelattacken und Sehstörungen sind ebenso wie ein erhöhter Ruhepuls häufig. Die Patienten wachen manchmal mit unangenehmem Herzklopfen auf. Objektivierbare Hinweise auf eine Herzmuskelentzündung wie Extrasystolen oder Reizleitungsstörungen sind dagegen eher selten. Die akute Lyme-Karditis kann zu einer passageren Myokardinsuffizienz mit Herzvergrößerung führen. Charakteristisch sind anfallsartige absolute Arrhythmien.
Passagere Kreatininerhöhungen und eine flüchtige Proteinurie als Zeichen einer Nierenbeteiligung werden meist übersehen. In dieser Phase II können auch bereits erste Gelenkentzündungen vorkommen. Dieses Stadium der Krankheit dauert unbehandelt wenige Wochen bis mehrere Monate.
Die Neuroborreliose mit Befall des Zentralnervensystems ist ein Sonderfall der Borrelieninfektion. Nur in einem Teil der Fälle (nach unserer Erfahrung circa 10%) kommt es zur Beteiligung des Zentralnervensystems (ZNS). Wenn diese auftritt, so in aller Regel in der frühen Phase (bis etwa 10 Wochen) der Erkrankung, in der noch keine Antikörper gebildet werden.
Bei der Neuroborreliose kann durch eine Untersuchung des Liquors und einen Vergleich mit den entsprechenden Serumwerten nachgewiesen werden, daß im ZNS selbst eine Antikörperproduktion stattfindet (sogenannte autochtone AK). Heute kann man Borrelien im Liquor mit kulturell oder mittels Polymerasekettenreaktion (PCR, siehe unten) nachweisen. Während man früher davon ausging, daß bei einer Borrelieninfektion das ZNS immer mit einem entzündlichen Liquorsyndrom beteiligt ist, weiß man heute, daß das klassische Vollbild der Meningopolyneuritis (Bannwarth-Syndrom) eher die Ausnahme darstellt. Die meisten Borreliosemanifestationen sind rein peripherer Natur.
Neuerdings wissen wir, daß die Infektion regelhaft vaskulitische Prozesse in Nerven, Muskulatur und Knochengewebe auslöst und daß das Auftreten von Symptomen davon abhängt, ob im jeweiligen Gebiet eine ausreichende kapilläre Reserve vorhanden ist [12].
Es ist derzeit Gegenstand der Diskussion, ob auch eine "neurotrope" Erregerausbreitung entlang peripherer Nerven ohne hämatogene oder lymphogene Streuung erfolgen kann. Sicher scheint inzwischen zu sein, daß die typischen Facialisparesen peripher bedingt und nicht immer mit einer Entzündung des Liquorraums verknüpft sind [15], [18]. Bei zahlreichen publizierten Kasuistiken war der Liquor auch in der Akutphase der Erkrankung nicht entzündlich verändert.
4.4 Latente Neuroborreliose
Pfister berichtet über Patienten, bei denen Borrelien aus dem Liquor angezüchtet werden konnten, ohne daß entzündliche Veränderungen nachweisbar waren. Man kann also sicher nicht in jedem Fall davon ausgehen, daß ein Fehlen entzündlicher Liquorveränderungen eine Neuroborreliose ausschließt. Vermutlich benötigt die entzündliche Reaktion einige Zeit, so daß manchmal zwar schon Borrelien den Liquorraum erreicht haben, aber noch keine Entzündung nachweisbar ist.
4.5 Der Erreger setzt sich fest: Das chronische Stadium III
Während der Generalisationsphase beginnt das körpereigene Immunsystem den Erreger zu bekämpfen. Antikörper (Abwehrstoffe) werden gebildet und auch die zelluläre Immunantwort (weiße Blutkörperchen) reduziert die Zahl der Borrelien drastisch. So überleben die Borrelien nur an einigen Stellen im Körper, die vom Immunsystem schlecht erreicht werden können, wie etwa im Bindegewebe. Hier überdauern sie in geringerer Zahl und können in unregelmäßigen Abständen zum Wiederaufflammen von Krankheitssymptomen führen. Diese können Monate bis Jahre nach Infektionsbeginn auftreten.
Typisch sind "von Gelenk zu Gelenk springende" Entzündungen. Auch Muskelentzündungen, Knochen- und Weichteilschmerzen (Fibromyalgien) sind typisch. Als Begleitsymptome am häufigsten sind chronische Entzündungen peripherer Nerven (Polyneuropathie vom fleckförmigen Typ).
Diese manifestieren sich vor allem in schmerzhaften Dysästhesien, die zum Beispiel ein Carpaltunnelsyndrom imitieren können. Die elektroneurografischen Befunde bleiben aber lange fast normal.
Eher selten sind chronische Enzephalitiden, wodurch ein hirnorganisches Psychosyndrom entstehen kann. Die Patienten sind dann oft wesensverändert und unkonzentriert. In einer eindrucksvollen Kasuistik wurde über eine Patientin berichtet, bei der die chronische Neuroborreliose unter dem Bild einer Anorexia nervosa ablief.
Vereinzelt wurde auch über Krankheitsbilder berichtet, die einem Schlaganfall ähneln. Dabei kann es - wohl auf dem Boden vaskulitischer Prozesse - auch zu Gefäßverschlüssen kommen, die computertomografisch und angiografisch nicht von Verschlüssen anderer Ätiologie zu unterscheiden sind. Die Diagnose wird in derartigen Fällen durch den Nachweis von Borrelienantikörpern im Liquor bzw. das entzündliche Liquorsyndrom gestellt [21]. Bei kernspintomografischen Untersuchungen können periventrikulär gelagerte Herdbefunde sichtbar werden, die nicht von den bei anderen entzündlichen Erkrankungen (z.B. multipler Sklerose) nachweisbaren Entzündungsherden unterscheidbar sind.
An der Haut der Extremitäten kann nach längerer Laufzeit die typische Acrodermatitis chronica atrophicans entstehen. Hierbei kommt es bevorzugt an Händen und Füßen zunächst zu einer kissenartig geschwollenen, blaurot verfärbten Haut meist über den Streckseiten der Gelenke. Später wird die Epidermis atrophisch und bekommt ein zigarettenpapierdünnes, transparentes Aussehen. Kombinationen mit einer Polyneuropathie und Knochenentkalkungen sind fast obligat (Literatur: Kristoferitsch, [3], [7]).
Auch das Herz kann von einer chronischen Borreliose betroffen sein. Stanek berichtet über eine chronische Form der Lyme-Karditis, die zu einer Kardiomyopathie führte. In diesem chronischen Stadium konnten Borrelien im Herzmuskel nachgewiesen werden. Es handelt sich also nicht um einen Autoimmunprozeß [33].
Die Induktion einer reaktiven Arthritis vom Reiter-Typ scheint bei disponierten Personen möglich zu sein. Dabei kommen auch Enthesiopathien wie Achillodynie oder Bursitiden vor [32]. Ob es sich dabei wirklich um eine klassische "reaktive" Arthritis handelt, scheint heute fraglich, da der Erreger tatsächlich zu persistieren scheint.
Augenbeteiligungen scheinen nicht so selten zu sein, wie früher angenommen. Alle Teile des Auges können betroffen sein: Iritis, Konjunktivitis, Uveitis, Papillitis, Vitritis, Panuveitis, Chorioretinitis (Literatur: Holak, Bialasewicz).
Auch über Hörstürze und eine Neuritis vestibularis wurde berichtet. Wir haben auch in Einzelfällen Ausfälle des Riechvermögens beobachtet.
Seltenere Manifestationen sind Myositis und Pannikulitis. Eine Hepatitis kommt wohl vor allem bei immungeschwächten Patienten vor. Fälle von subakuter Hepatitis oder Splenitis dürften oft unbemerkt bleiben.
4.6 Borreliose in der Schwangerschaft
Eine Infektion des ungeborenen Kindes in der Schwangerschaft ist möglich. Dabei können syphilisähnliche Mißbildungen induziert werden [3], [7], [44]. Einige Befunde sprechen dafür, daß bei Infektionen in der Frühschwangerschaft vermehrt Fehlgeburten stattfnden. Grundsätzlich besteht die Gefahr dann, wenn eine Schwangere frisch mit einer Borreliose infiziert wird und noch keine Antikörper besitzt. Bei chronischen Infektionen, bei denen der Erreger ja nicht mehr im Blutkreislauf zu finden ist, ist das Infektionsrisiko deutlich geringer [43].
4.7 Übertragung durch Blut?
Theoretisch können die Erreger auch über Blutkonserven übertragen werden, da sie eine Kühlschranklagerung überstehen. Da die Bakteriämie (Borrelien kreisen in der Blutbahn) bei der Borreliose aber nur sehr kurz auftritt, ist eine derartige Übertragung sicher sehr selten.
4.8 Krebs durch Borrelien?
Reaktive Lymphome (Borrelienlymphozytom) können entweder im Stadium I (monotop im Zentrum der Stichstelle) oder sehr selten als polytope Lymphome in der Spätphase beobachtet werden. Ein Übergang in maligne Lymphome wurde in Einzelfällen beschrieben [41].
4.9 Wie machen Borrelien krank?
Im Prinzip entstehen die Krankheitssymptome durch die hohe Affinität der Borrelien zur kollagenen Faser. Sie können sich regelrecht in die Bindegewebsfasern "einschrauben". So kommt es vor allem im Bindegewebe (Kollagen) zu chronischen Entzündungsprozessen. Die Folge sind Gefäßentzündungen: Vaskulitische Prozesse mit perivaskulären Infiltraten von Lymphozyten und Plasmazellen (Literatur: de Koning, [12], [15], [18]). Nachfolgende Kapillarverschlüsse führen zu Störungen der Energieversorgung in den betroffenen Geweben, z. B. durch eine Entzündung der Gefäße, von denen Nerven versorgt werden (Epineurium). Dies wiederum führt zu (Ischämie-) Schmerzen und vermehrter Vulnerabilität. So sind wohl auch die bei längerem Verlauf typischen Entkalkungen des Knochens in der Umgebung entzündeter Gelenke Folge der schlechten lokalen Versorgung des Knochengewebes.
Die Borrelien können sich im Kollagen vermutlich teilweise dem Zugriff des Immunsystems entziehen. Dort sind sie auch für Antibiotika schlecht erreichbar.
Die Allgemeinsymptome im Verlauf der Infektion werden durch die Reaktion des Immunsystems auf die Borrelien (infektionsbedingte Produktion von Tumornekrosefaktor und Interleukin aus Makrophagen) bedingt. Die Stärke der Allgemeinsymptome scheint mit der Erregerzahl zu korrelieren.
Es gibt bisher keine vernünftigen Beweise für die Induktion eines autoimmunologischen Prozesses, der ohne Erregerpersistenz in der Lage wäre, den Krankheitsprozeß zu unterhalten.
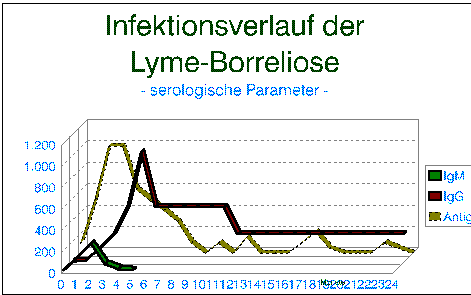
5.1 Serologische Diagnostik
Die Borrelieninfektion ist grundsätzlich in jedem Stadium der serologischen Diagnostik zugänglich. Dabei ist allerdings zu beachten, daß insbesondere in den ersten 4 bis 6 Wochen noch nicht in jedem Fall Antikörper nachweisbar sind. Die humorale Immunantwort benötigt mindestens 2 Wochen, bis die ersten Antikörper nachweisbar werden.
Während eines Erythema migrans sind daher nur 40-50% der Patienten bereits seropositiv, beim Bannwarth-Syndrom sind es je nach Verfahren etwa 60-80%. In der Spätphase sind dagegen in praktisch allen Fällen eindeutige Antikörper nachweisbar. Daher muß in Zweifelsfällen gerade beim Verdacht auf eine frühe Borreliose die Untersuchung unter Umständen im Abstand einiger Wochen wiederholt werden. Die Diagnose eines Erythema migrans darf aber niemals vom Antikörperstatus abhängig gemacht werden!
Aufgrund unterschiedlicher Verfahren (Enzymimmunoassay [EIA], Immunfluoreszenz [IFT], Hämagglutinationshemmtest [HAH] etc.) und fehlender Standardisierung sind Werte aus verschiedenen Labors nur bedingt vergleichbar. Zum Teil ist dies durch die Präparation der Tests aus unterschiedlich geeigneten (immunogenen) Borrelienstämmen erklärbar.
Aus bisher unbekannten Gründen sind in der Akutphase der Erkrankung oft keine IgM-Antikörper nachweisbar. Werden aber IgM-Antikörper nachgewiesen, beweisen sie in der Regel eine noch frische, aktive Erkrankung. Das Fehlen von IgM-Antikörpern schließt aber eine behandlungsbedürftige Borrelien-Infektion keineswegs aus. Gerade in der Spätphase sind in der Regel keine IgM-Antikörper mehr nachweisbar, obwohl noch lebende Borrelien vorhanden sind.
Bei einigen Krankheiten können falsch positive Ergebnisse der Serologie durch unspezifische Kreuzreaktionen vorkommen: Akute Herpes- oder Epstein-Barr-Virus-Infektionen können falsch positive Borrelien-IgM-Antikörper, ANA-positive Seren können eine positive Borrelien-IgG-Reaktion vortäuschen. Daneben sind Kreuzreaktionen durch andere Spirochätosen (z.B. Lues) möglich.
In Zweifelsfällen kann als Bestätigungstest der Westernblot eingesetzt werden. Durch ihn ist eine Differenzierung zwischen unspezifischen Kreuzreaktionen und echten immunologischen Reaktionen gegen Borrelien möglich. Bei der Interpretation serologischer Befunde sind einige Besonderheiten zu beachten. Die immunologische Auseinandersetzung zwischen Borrelien und Immunsystem führt zu einer typischen zeitlich gestaffelten Antikörperkinetik. Zuerst erkennt das Immunsystem Strukturen an der Oberfläche der Borrelien. Dazu gehören das Flagellin und die sogenannten "Outer surface proteins" (abgekürzt OSP A und B). Die intrazellulär gelegenen antigenen Strukturen werden erst im späteren Krankheitsverlauf vom Immunsystem erkannt.
Aus diesem Grund erscheint im Westernblot zuerst eine 41kD-Bande, die gegen das Flagellin gerichtet ist. Es folgen das 21kD pC-Protein und (nicht regelmäßig) die 31/34kD Osp-Banden und schließlich als letztes die 94kD-Bande, die gegen ein intrazelluläres Antigen gerichtet ist. In Frühstadien der Krankheit ist daher oft nur eine 41kD-Linie nachweisbar, im Stadium der Arthritis sollte normalerweise auch eine 94kD-Linie vorhanden sein. Zur Interpretation eines Westernblot ist es daher absolut unerläßlich zu wissen, welches klinische Bild der Patient aufweist.

5.2 Gibt es "seronegative" Borreliosen?
Immer wieder wird behauptet, man könne auch im chronischen Stadium der Borreliose nicht immer Antikörper im Blut nachweisen. Dies ist nicht richtig. Lediglich in der Anfangszeit der Borreliendiagnostik gab es nicht wenige Fälle, in denen die anfangs noch sehr unterschiedlichen Tests versagt haben. Heutige Tests, vor allem der Westernblot, sind aber sehr zuverlässig.
Generell gilt: Wenn ein Mensch durch Bakterien erkrankt (also aktuelle Symptome aufweist), so "merkt" dies das Immunsystem selbstverständlich und antwortet mit der Bildung von Antikörpern. Je intensiver die Krankheit, desto mehr gilt dies. Je länger und intensiver die Auseinandersetzung zwischen Borrelien und Immunsystem war, desto ausgeprägter ist das Bandenmuster im Westernblot. Es ist deshalb nicht vorstellbar, daß ein Patient im Spätstadium der Erkrankung nur ganz wenige oder gar keine Banden im Westernblot aufweist.
Wir halten deshalb die Meinung für überholt, daß ein negativer Test eine Borreliose nicht ausschließen würde. (Dies gilt natürlich nur für das chronische Stadium, da im Frühstadium tatsächlich oft noch keine Antikörper gebildet wurden). Aus diesem Grund steht oft der Satz "Bei weiterbestehenden klinischem Verdacht Kontrolle in zwei Wochen!" auf serologischen Befundberichten. Für das Spätstadium gilt dies nicht!
5.3 Direktnachweis von Borrelienantigenen mittels PCR
Ein neues, bisher allerdings noch nicht ausreichend geprüftes Verfahren weist Bestandteile der Borrelien (also nicht Antikörper!) direkt in Körpersekreten oder Geweben (auch im Urin) nach. Hierzu wird die Polymerase-Ketten-Reaktion (PCR) verwendet.
In der Frühphase der Infektion, wenn noch hohe Erregerzahlen vorhanden sind, könnte dieser Antigennachweis relativ zuverlässig sein. In der Spätphase wird der Test unter Umständen nur während der akuten Schübe positiv. Vermutlich ist dieser Test aber besser zur Therapiekontrolle geeignet als die serologischen Tests. Nach einer erfolgreichen Therapie sollte er negativ werden. Zur Zeit gibt es aber noch Probleme mit diesem Verfahren, so daß es noch nicht in der Routine eingesetzt werden kann. Bis diese Probleme ausgeräumt sind, sollte der Urintest mit Vorsicht interpretiert werden.
Besonders spektakulär ist aber das Ergebnis einer Würzburger Arbeitsgruppe, daß seropositive Patienten, die zu diesem Zeitpunkt keine Krankheitssymptome hatten, Borrelien-DNA im Urin ausschieden. Wir konnten nachweisen, daß in vielen Fällen im Rahmen akuter Krankheitsschübe eine Ausscheidung erfolgt [69]. Dies ist ein hartes Argument gegen die häufig geäußerte Annahme, ein positiver serologischer Test sei nur als Durchseuchungstiter im Sinne einer früher durchgemachten Infektion zu werten.
5.4 Serologische Therapiekontrolle
Nach (erfolgreicher) Therapie einer Borrelieninfektion klingen die Antikörper langsam ab. Dabei besitzen IFT-gemessene Titer eine andere zeitliche Kinetik als EIA-gemessene. Grundsätzlich hängt das davon ab, welche Proteine der Test erkennt. Erkennt er nur Flagellin, hat er eine andere Abklingkurve, als wenn er OSP A/B oder das 94 KD-Protein erkennt. Man kann also nur für jeweils identisch präparierte Tests eine Kinetik angeben.
EIA-Tests, die einen Borrelien-Gesamtextrakt verwenden, klingen anders ab als Flagellin-EIAs. Mit einem Flagellin-EIA gemessene Titer bleiben über Monate bis Jahre nachweisbar. IFT-IgG-Titer klingen nach unserer Erfahrung ähnlich wie moderne EIA-Tests um etwa eine Titerstufe allem drei Monate ab. Daher ist es unsinnig, unmittelbar nach Ende einer Therapie den Titer erneut zu messen (dies wäre nur bei Nachweis von IgM-Antikörpern sinnvoll).
Der Westernblot ist als Therapiekontrolle für kurze Zeiträume ungeeignet, da einmal vorhandene Banden nach der Therapie nur in sehr langen Zeiträumen verschwinden. Nach einigen Jahren lassen sich aber auch im Westernblot Änderungen nachweisen.
5.5 Mikrobiologische Verfahren
Die Anzucht von Borrelien aus Gewebeproben ist prinzipiell möglich, bleibt aber wegen der technischen Probleme Speziallaboratorien vorbehalten. Die Anzucht aus Hautbiopsien im Bereich eines Erythem-migrans, oder einer ACA gelingt recht oft, aus Liquor eher selten, aber immer öfter, aus Gelenkpunktaten praktisch nie.
Andererseits können bei der ACA, die einen Verlauf von Jahrzehnten haben kann, noch Borrelien aus Hautbiopsien angezüchtet werden. In solchen Fällen kann der direkte Erregernachweis als Therapiekontrolle dienen. Inzwischen gibt es in jedem Krankheitsstadium und bei jeder Manifestation Berichte über eine erfolgreiche Erregeranzucht. Es ist also davon auszugehen, daß die Erreger der Borreliose chronisch persistieren können. Früher wurde oft argumentiert, die Borreliose habe eine hohe spontane Heilungsquote und die nachweisbaren Antikörper seien nur Ausdruck einer früher durchgemachten Erkrankung. Heute wissen wir, daß auch in den chronischen Stadien mit zum Teil jahrelangem Verlauf noch Erreger anzüchtbar sind. (Wir haben bei einem Patienten mit einem disseminierten Lymphom noch nach sieben Jahren den Erreger nachweisen können; bei einem anderen Patienten überlebten kultivierbare Borrelien in der Haut trotz viermaliger hochdosierter intravenöser Therapie).
Auch aus anderen Gewebeproben kann prinzipiell mittels PCR der Erregernachweis geführt werden. Ein negativer Befund ist aber vorsichtig zu interpretieren (die PE könnte "danebengelegen" haben).
Technische Durchführung einer Probeexzision der Haut: Sorgfältigste Hautdesinfektion. Versand in sterilem Röhrchen ohne Zusätze (eventuell auf einem Läppchen mit steriler Kochsalzlösung) an ein Labor, welches derartige Leistung erbringt (etwa: Pettenkoferinstitut, Pettenkoferstraße 9a, 80337 München).
Anforderung: Borrelienanzucht aus Haut-PE (oder Liquor etc).
Achtung: Das Pettenkoferinstitut kann nicht über allgemeine Kassen abrechnen!
Die Anforderungen an eine Therapie der Borreliose hängen entscheidend vom Stadium der Erkrankung ab. Im Frühstadium gibt es noch keine Durchblutungsprobleme durch vaskulitische Prozesse, die die Penetration des Antibiotikums behindern würden. Daher ist hier eine orale Therapie (Tabletten) meist ausreichend. Auch bei Kindern genügt in vielen Fällen eine orale Therapie vermutlich wegen der anderen Struktur des kindlichen Bindegewebes, das weniger Kollagen und mehr Proteoglykansulfat enthält.
Ferner ist zu berücksichtigen, daß die Erreger nur in der Teilungsphase für ein Antibiotikum empfindlich sind. Ruhende Keime ("Persister") können unter Umständen die Therapie überdauern. Wegen der langen Generationszeit der Borrelien (8 - 35 Stunden) sind Persister vermutlich nicht selten. Nach derzeitigem Stand der Kenntnisse dürfte daher eher eine Wiederholung der Therapie als eine noch längere Therapiedauer erfolgversprechend sein.
Grundsätzlich sind nach in-vitro-Untersuchungen (Tests "im Reagenzglas") Tetracycline, Doxicyclin, Erythromycin, Amoxicillin, Cefotaxim und Ceftriaxon am wirksamsten. Die Mittleren Hemmkonzentrationen [MHK90]-Werte liegen zwischen 0,05 und 1 mg/l. Für Penicillin G wurden dagegen Werte bis 8 mg/l gemessen. Auch im Tierversuch waren die Ergebnisse mit Penicillin und Erythromycin enttäuschend [67]. Daher ist heute Penicillin nicht mehr das Präparat der Wahl, zumal vermehrt über die erfolgreiche Anzucht des Erregers auch nach hochdosierter Penicillintherapie berichtet wurde [67], [68].
Erythromycin hat trotz hervorragender in-vitro-Werte bisher klinisch und im Tierversuch enttäuscht, was an unzureichenden Gewebespiegeln liegen könnte. Das neuere Makrolid Azithromycin konnte in einer größeren Studie [Strle] dagegen überzeugen.
Bei der Therapieplanung ist immer zu berücksichtigen, daß eine systemische Infektion therapiert werden muß. Das Verschwinden einer Hautläsion beweist keinesfalls die Heilung der Krankheit. Hier gibt es wichtige Parallelen zur Syphilis, wo ebenfalls Spätmanifestationen bei vermeintlich ausreichend therapierten Patienten beobachtet werden.
Die verwendeten Antibiotika dürfen nicht unterdosiert werden. Es ist mit Sicherheit sinnlos, eine Lyme-Arthritis mit 100 mg Doxicyclin oral täglich therapieren zu wollen. Bei 200 mg Doxicyclin oral als Einzeldosis erreicht man Serumspiegel von etwa 3 - 4 mg/l. Dies reicht nicht aus, um auch Keime in schlecht zugänglichen Geweben zu erreichen. Zum Vergleich: Cefotaxim, Erythromycin und Doxicyclin haben eine vergleichbare Aktivität gegen Borrelien; im Fall des Cefotaxim werden 6000 mg täglich gegeben, also wesentlich höhere Spiegel erreicht!
Viele vermeintliche Therapieversager dürften lediglich auf erhebliche Unterdosierungen zurückzuführen sein! Es ist auch sicher nicht sinnvoll, bei Versagen eines "optimalen" Regimes auf ein minder wirksames auszuweichen.
![[Image]](panostitis-dateien/minimal.jpg)
6.1 Empfehlungen zur Therapie (Stand 8/1996)
Stadium I (Lokalinfektion):
Doxicyclin 2 x 100 mg täglich oral über 3 Wochen
Für Kinder und als Reserve ist Amoxicillin (z. B. 3 x 1 g bei Erwachsenen)
geeignet, eventuell in Kombination mit Probenecid. Die Kombination mit Clavulansäure
(Augmentan) ist unsinnig (Borrelien bilden keine Penicillinase!).
Bei Allergikern evtl. Azithromycin (Zithromax).
Stadium II (Generalisationsphase):
Cefotaxim (Claforan) 2 x 3 g/Tag iv über 12 - 14 Tage
Ceftriaxon (Rocephin) 2 bis 4 g/Tag über 12 - 14 Tage
Reserve: Doxicyclin 2 x 100 mg iv über 21 Tage
Imipenem (Zienam), Azithromycin (Zithromax)
Stadium III (Spätmanifestationen > 6 Monate):
Cefotaxim (Claforan) 2 x 3 g/Tag über 14 (- 21) Tage
Ceftriaxon (Rocephin) 4 g über 14 (- 21) Tage
Reserve : Doxicyclin iv, Imipenem
Versagen der Therapie:
Wiederholung mit evtl. noch höherer Dosierung (z. B. 3 x 4 g Cefotaxim). In den
wenigen wirklich therapierefraktären Fällen kann eine "gepulste"
Hochdosistherapie mit Cefotaxim versucht werden [62].
6.2 Gibt es Borreliosen, die nicht mehr therapierbar sind?
J.J.Burrascano (East Hampton, New York) behauptet in einem Artikel, der neuerdings auch in Deutsch über das Internet (http://ix.urz.uni-heidelberg.de/ ~ cn6/zecken/burras_g.htm) verbreitet wird, in vielen Fällen sei eine praktisch lebenslange Therapie erforderlich, weil die Borreliose nicht ausheilen würde. Unsere Daten sprechen absolut gegen diese Meinung: Wir haben bislang mehr als 500 Patienten mit chronischer Borreliose therapiert, von diesen stammen folgende Zahlen: Circa 80% dieser Patienten ließen sich mit einem Therapiezyklus (Claforan 2 x 3 g/14 Tage) sanieren, von den verbleibenden 20% benötigten 2/3 einen zweiten, einige wenige einen dritten oder gar vierten Zyklus. Ganze vier Patienten benötigten bisher mehr als vier Therapien, wobei in diesen Fällen meist eine erneute Infektion stattgefunden hat.
Läßt sich kein Therapieeffekt erzielen, sollte das auch Anlaß sein, das verwendete Therapieregime und auch die Diagnose kritisch zu überprüfen! Gerade in solchen Fällen sollte immer wieder der Versuch gemacht werden, eine Erregerpersistenz zu beweisen (kulturell oder mit PCR).
Bei aller "Ehrfurcht" vor der Borreliose sollte man nie vergessen, daß es noch andere Krankheiten gibt, die ebenfalls die jeweiligen Beschwerden verursachen könnten.
6.3 Therapieprobleme
Bei Therapiebeginn ist mit der Möglichkeit einer Herxheimer-Reaktion zu rechnen: Der Patient wird nach wenigen Stunden auffallend blaß, bekommt manchmal Schüttelfröste und eventuell Fieber und eine deutliche Vasokonstriktion. Am zweiten Tag kehrt sich dieser Effekt um: Der Blutdruck fällt infolge starker Vasodilatation, der Patient zeigt eine starke Gesichtsrötung und klagt über Abgeschlagenheit, Kopf- und Muskelschmerzen. Am dritten Tag verschwindet in der Regel diese Reaktion, Gelenkbeschwerden können sich allerdings protrahiert über mehrere Tage verschlechtern. Gelenkergüsse können sogar erstmalig unter Therapie auftreten [64]. Bei Infusionsbehandlung mit einem der Cephalosporinpräparate ist die Herxheimer-Reaktion praktisch immer zu beobachten. Tritt sie nicht auf, sind Zweifel an der Diagnose erlaubt. Die Herxheimer-Reaktion wird mit großer Wahrscheinlichkeit durch die Freisetzung von Tumornekrosefaktor (TNF) bzw. Interleukinen aus stimulierten Makrophagen ausgelöst.
Zur Prophylaxe der Herxheimer-Reaktion hat sich Triamcinolon (Volon solubile) in einer Dosierung von 80 mg intravenös 60 Minuten vor der ersten Infusion bewährt. Bei oraler Therapie im Stadium I ist dies nicht nötig. Die Herxheimer-Reaktion wird durch die Corticoid-Prophylaxe nicht vollständig, aber weitgehend unterdrückt.
Allergische Zwischenfälle sind selten. Bei unseren 450 Therapien mit Claforan beobachteten wir 3 allergische Sofortreaktionen und 21 Allergien vom verzögerten Typ (meist in Form eines Hautausschlages ab dem 9. Tag).
Bei Rocephin sind Durchfälle häufig (fast 40 %).
6.4 Kontrolle und Nachsorge
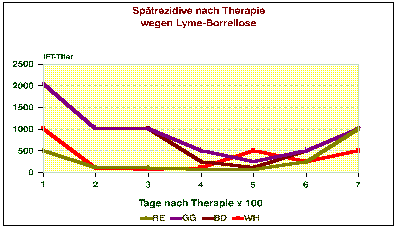
Alle drei Monate nach Therapie wird nach klinischen und serologischen Kriterien der Verlauf kontrolliert. Der Therapieerfolg wird in erster Linie klinisch beurteilt, da zuverlässige Laborparameter zur Feststellung einer Heilung nicht existieren. Der mit Immunfluoreszenztest gemessene IgG-Titer fällt oft, aber nicht immer nach erfolgreicher Therapie um etwa eine Titerstufe in drei Monaten ab. Für den Enzymimmuntest ist dies nicht einheitlich zu beantworten. Jeder Test scheint seine eigene Kinetik zu haben (siehe 5.4).
Es ist nicht sinnvoll, unmittelbar nach Therapieende den Titer zu kontrollieren, weil der Titer infolge vermehrter Antigenpräsentation oft sogar noch einmal kurzfristig ansteigt. Die Kontrolle der Antigenausscheidung im Urin (siehe oben) scheint dagegen ein besseres Verfahren zur Kontrolle des Therapieeffektes zu sein.
Rezidive sind auch noch nach bis zu zwei Jahren möglich. Vermutlich werden sie von Persistern im Kollagen ausgelöst. In dieser erneuten Vermehrungsphase der Erreger lassen sich dann auch wieder Erregerproteine im Urin nachweisen. Die Nachsorge muß unbedingt auch einen möglichen Symptomwechsel erfassen (der Arthritiker sucht eventuell eine andere Ambulanz auf als der Patient mit Symptomen der Frühphase!)
6.5 Prophylaxe
Bisher gibt es weder eine wirksame Prophylaxe noch einen Impfstoff. Die Entwicklung eines Impfstoffes ist außerordentlich kompliziert, weil die Borrelien an ihrer Oberfläche zahlreiche unterschiedliche antigene Strukturen tragen und bisher kein Antikörper mit Schutzwirkung beim Menschen bekannt ist. Mehrere Arbeitsgruppen arbeiten an einer Impfstoffentwicklung. Wenn es überhaupt gelingen sollte, einen Impfstoff zu entwickeln, so wird dies sicher noch Jahre dauern.
7.1 Allgemeine Übersichtsliteratur
(1) Ackermann R.: Erythema migrans Borreliose und Frühsommer-Meningo-encephalitis.
Deutsches Ärzteblatt 83 (1986) 1765-1774
(2) Steere A.: Lyme disease. (Übersichtsarbeit) New Engl. J.Med, 1989 Aug
(3) Weber K.: Lyme Borreliose. Hautarzt 37 (1986) 583
Kleine und große Bücher zum Thema
(4) Herzer P.: Lyme Borreliose. Steinkopff Verlag Darmstadt, ca 75.-DM. Enthält
hauptsächlich Daten aus der Münchner Rheumaambulanz, teilweise gute
Abbildungen, Stand 1989
(5) Horst H.: Einheimische Zeckenborreliose bei Mensch und Tier (2.Auflage),
Perimed-Verlag, ca 80.-DM. Deutlicher Schwerpunkt auf der Zeckenbiologie,
weniger zur Klinik.
(6) Hassler D.: Fortschritte der Infektiologie: Lyme-Borreliose, MMW-Verlag München,
ca. 40.-DM. Dies ist in erster Linie ein Kongreßbericht mit zahlreichen
Einzelbeiträgen, hauptsächlich zu Serologie und Therapie, Stand 1992
(7) Weber K. und Burgdorfer W.: Aspects of Lyme Borreliosis, Springer-Verlag
Heidelberg, ca 240.-DM, in Englisch. Dies ist ein sehr umfangreiches, sehr gutes
Buch über alle Aspekte der Borreliose. Eher konservativ geschrieben, neuere
Techniken und Entwicklungen fehlen.
7.2 Spezielle Literatur
Die MEDLINE enthält im Juni 1994 fast 3000 Arbeiten zur Borreliose. Falls spezielle Fragen zu beantworten sind, lohnt sich eine Recherche.
Zu Vektoren und Epidemiologie
(8) Fahrer H, SM van der Linden, MJ Sauvain, L Gern, E Zhioua, A Aeschlimann:
The prevalence and incidence of clinical and asymptomatic Lyme borreliosis in a
population at risk. J Infect dis 163 (1991) 305-310
(9) Gustafson R, B Svenungsson, A Gardulf, G Stiernstedt, M Forsgren: Prevalence
of tick-borne encephalitis and Lyme borreliosis in a defined Swedish population.
Scand J Infect Dis 22 (1990) 297-306
(10) Hassler D.: Lyme Borreliose in einem europäischen Endemiegebiet, Dtsch Med
Wschr. 117 (1992) 767-74
Zur Pathophysiologie und Histologie
(11) Defosse DL, Johnson RC: In vitro and in vivo Induction of Tumor Necrosis
Factor Alpha by Borrelia burgdorferi, Infection and Immunity (Mar 1992), 1109-13
(12) Duray PH, Steere AC: Clinical pathologic correlations of Lyme disease by
stage. Ann N Y Acad Sci 539 (1988) 65-79
(13) Krüger H, Pulz M, Martin R, Stich-Groh V: Long terme persistence of
specific T- and B-Lymphocyte responses to Borrelia burgdorferi following
untreated neuroborreliosis. Infection 18 (1990) 263-267
(14) Ma Y, Sturrock A , Weis JJ: Intracellular localization of Borrelia
burgdorferi within human endothelial cells. Infection and Immunity 59 (1991)
671-678
(15) Meier C, Grehl H: Vaskulitische Neuropathie bei
Garin-Bujadoux-Bannwarth-Syndrom. Dtsch. med. Wschr. 113(1988) 135-138.
Zur Klinik des Frühstadiums
(16) Dammin GJ: Erythema migrans: A chronicle. Rev Infect Dis 11 (1989)
142-151
(17) Steere AC et al: Treatment of the early manifestations of Lyme disease. Ann
Intern Med 99 (1983) 22-26
Zur Klinik des neurologisch betonten Stadiums II (Bannwarth-Syndrom)
(18) Meier C, Reulen HJ et al: Meningoradiculoneuritis mimicking vertebral disc herniation. A "neurosurgical" complication of Lyme-borreliosis. Acta neurochir (Wien) (1989), 98
Zur Differentialdiagnose in der Neurologie
(19) Ackermann R, Gollmer E, Rehse-Küpper B: Progressive
Borrelien-Encephalomyelitis- Chronische Manifestation der
Erythema-migrans-Krankheit am Nervensystem. Dtsch.med.Wschr. 109 (1985)
1039-1042
(20) Barnett W, Sigmund D, Roelcke U und Mundt CH: Endomorphes
paranoidhalluzina-torisches Syndrom durch Borrelienencephalitis. Nervenarzt 62
(1991) 445-447
(21) Belau C, Mühler E: Zerebrovaskuläre Manifestation einer chronischen
Neuroborreliose. Akt. Neurol. 18 (1991) 65-68
(22) Logician EL, Kaplan RF, Steere AC: Chronic neurologic manifestations of
Lyme disease. N Engl J Med 323 (21) 1990 1438-44
(23) May EF, Jabbari B: Stroke in neuroborreliosis. Stroke 21 (1990) 1232-35
(24) Olson JE, Zbornikova V: Neuroborreliosis simulating a progressive stroke.
Acta Neurol scand 81 (1990) 471-74
(25) Pfister HW, Preac-Mursic V, Wilske B, Einhäupl KM, Weinberger K: Latent
Lyme neuroborreliosis: Presence of Borrelia burgdorferi in the cerebrospinal
fluid without concurrent inflammatory signs. Neurology 39 (1989) 1118-20
(26) Reeß J, Mauch E, Kornhuber HH: Subakutes organisches Psychosyndrom als
klinische Manifestation einer Infektion mit Borrelia burgdorferi im Stadium II
ohne weitere neurologische Störungen. Nervenarzt 62 (1991) 514-515
Zur Klinik der Lyme-Arthritis
(27) Eichenfield AH, Goldsmith DP, Benach JL et al: Childhood Lyme arthritis
- experience in an endemic area. J Pediatr 109 (1986) 753-758
(28) Herzer P, Wilske B: Lyme Arthritis in Germany. Zbl Bakt Hyg A 263 (1986),
268-74
(29) Hovmark A, Asbrink E, Olson I: Joint and Bone involvement in swedish
Patients with Ixodes ricinus borne Borrelia Infection. Zbl Bakt Hyg A 263 (1986)
275-84
(30) Steere AC, Dwyer E, Winchester R: Association of chronic Lyme arthritis
with HLA-Dr4 and HLA-Dr2-Alleles. New Engl J Med 323 (1990) 219-223
(31) Szer IS, Taylor E, Steere AC: The long term course of Lyme arthritis in
children. New Engl J Med 325, 3 (1991)159-163
(32) Weyand CM, Goronzy JJ: Immune responses to Borrelia burgdorferi in Patients
with reactive Arthritis. Arthritis and Rheumatism 32 No.9, September 1989
Zur akuten und chronischen Lyme-Karditis/Kardiomyopathie
(33) Stanek G, Klein J, Bittner R, Glogar D: Isolation of Borrelia
burgdorferi from the myocardium of a patient with longstanding cardiomyopathy.
New Engl J Med 322 (1990) 249-252
(34) van der Linde et al: Range of atrioventricular conduction disturbances in
Lyme borreliosis: A report of four cases and review of other published reports.
Br Heart J 63 (1990) 162-168
(35) Wunderlich E, Graf A, Thess G, Foelske H: Z Kardiol 79 (1990) 599-600
Zur Acrodermatitis
(36) Asbrink E, Hovmark A, Hederstedt B: The spirochetal etiology of
Acrodermatitis chronica atrophicans Herxheimer. Acta derm vener (Stockholm) 64
(1984) 506
(37) Asbrink E, Hovmark A: Successful cultivation of spirochetes from skin
lesions of patients with erythema chronicum migrans afzelius and acrodermatitis
chronica atrophicans. Acta pathol Microbiol Immunol Scand Sect B 93 (1985)
161-163
(38) Langer K, Diem E: Acrodermatitis chronica atrophicans und sklerodermiforme
Hautveränderungen bei Borrelien-Infektion. Hautarzt 39 (1988) 647-651
Zu anderen Hautsymptomen (Rash, Lymphome, LSA, Morphaea, BLI)
(39) Abele DC, Anders KH, Chandler FW: Benign lymphozytic infiltration
Jessner Kanoff: Another manifestation of borreliosis? J Am Acad Dermatol 21
(1989) 795-797
(40) Detmar U, Maciejewski W, Link C, Breit R, Sigl H, Robl H und Preac-Mursic
V: Ungewöhnliche Erscheinungsformen der Lyme-Borreliose. Hautarzt 40 (1989)
423-429
(41) Garbe C, Stein H, Gollnick H, Taud W und Orphanos CE: Kutanes
B-Zell-Lymphom bei chronischer Borrelia-burgdorferi-Infektion. Hautarzt 39
(1988) 717-726
(42) Hassler D, Zorn J, Zöller L et al: Noduläre Pannikulitis: Eine
Verlaufsform der Lyme-Borreliose? Hautarzt 43 (1992) 134-138
Zu gynäkologischen Komplikationen
(43) Edly SJ.: Lyme Disease during pregnancy. New Jersey Medicine 87 (1990)
557-560
(44) MacDonald AB.: Gestational Lyme borreliosis: Implications for the fetus.
Rheum Dis Clin North Am 15 (1989) 657-77
(45) Strobino BA, Williams cl et. al: Am J Obstet Gynecol 169 (1993) 367-74
Zur Manifestation im Kindesalter
(46) Huppertz HI.: Childhood Lyme borreliosis in Europe. Eur J Pediatr 149
(1990) 814-821
(47) Naglo AS, Wide K: Borrelia infection in Children. Acta Paediatr Scand 78
(1989) 918-22
Zu Augensymptomen
(48) Winterkorn JM.: Lyme disease: Neurologic and ophthalmic manifestations. Surv Opthalmol 35 (1990) 191-204
Zu "exotischen" Manifestationen
(49) Kristof V, Bozsik BP, Szirtes M, Simonyi J: Lyme borreliosis and Raynaud´s
Syndrome. Lancet 1990 Apr 21, 975-976
(50) Lauer M, Stolze K, Hatz HJ, Helmke K, Löffler W: Granulomatous
thrombophlebitis in Lyme borreliosis. Immun Infekt 18 (1990 57-58
(51) Mokry M, Flaschka G, Kleinert G, Kleinert R, Fazekas F, Kopp W: Chronic
Lyme disease with an expansive granulomatous lesion in the cerebellopontine
angle. Neurosurgery 27 (1990) 446-451
(52) Rank EL, Dias SM, Hasson J, Duray PH, Johnson RC, Magnarelli LA, Fister RD:
Human necrotizing splenitis caused by Borrelia burgdorferi. Am J Clin pathol 91
(1989) 493-498
(53) Schoenen J, Sianard -Gainko J, Carpentier M, Reznik M.: Myositis during
Borrelia burg-dorferi infection. J Neurol Neurosurg Psychiatr 52 (1989)
1002-1005
Zur serologischen Diagnostik
(54) Golightly MG, Thomas JA, Viciana AL: The laboratory Diagnosis of Lyme
Borreliosis Laboratory Medicine 21, 5 (1990) 299-304
(55) Lindenmayer J, Weber M, Bryant J, Marquez E, Onderdonk A: Comparison of
indirect immunofluorescent assay, enzyme-linked immunosorbent assay, and Western
immunoblot for the diagnosis of Lyme diesease in dogs. J. Clin Microbiol 28
(1990) 92-96
(56) Magnarelli LA.: Serologic testing for Lyme disease. Postgrad Med 87 (1990)
149-156
Zur Therapie
(57) Caperton EM, Heim-Duthoy KL, Matzke GR, Peterson PK, Johnson RC:
Ceftriaxone therapy of chronic inflammatory arthritis. A Double blind placebo
controlled trial. Arch intern med 150 (1990) 1677-82
(58) Dattwyler RJ, Halperin J, Volkman DJ, Luft BJ: Treatment of late
Lyme-Borreliosis - Randomised comparison of Ceftriaxone and Penicillin. Lancet
1988/1 1191-1194
(59) Dattwyler RJ, Volkman DJ, Conaty SM, Platkin SP, Luft BJ: Amoxicillin plus
probenecid versus doxycycline for treatment of erythema migrans borreliosis.
Lancet 1990 Dec 8, 1404-1406
(60) Halperin, JJ Abnormalities of the Nervous system in Lyme disease: Response
to antimicrobial therapy. Reviews of infectious diseases Vol II, Supplement 6,
Sept/Oct 1989
(61) Hassler D, Zöller L et al: Cefotaxime versus Penicillin G in Late Lyme
Borreliosis- Randomised prospective therapeutic study. Infection 18 (1990)
(62) Hassler D, Riedel K, Zorn J, Preac-Mursic V: Pulsed high-dose cefotaxime
therapy in refractory lyme borreliosis. Lancet 338, July 20, 1991
(63) Pfister HW, Preac-Mursic V, Wilske B, Schielke E, Sorgel F, Einhäupl KM:
Randomised comparison of ceftriaxone and cefotaxime in Lyme neuroborreliosis. J
Infect Dis 163 (1991) 311-318
(64) Steere AC et al: Treatment of the early manifestations of Lyme Disease.
Annals of intern Med 99 (1983) 22-26
(65) Zöller L, Haude M, Hassler D: Spontaneous and post-treatment antibody
kinetics in late Lyme borreliosis. Serodiagnosis and Immunother. in inf. Dis. 3
(1989) 345-353
Zu Fragen der Mikrobiologie (Erregeranzucht, Empfindlichkeit)
(66) Cryan B, Wright DJ: Antimicrobial agents in Lyme disease. J Antimicr
Chemother 25 (1990) 187-190
(67) Preac-Mursic V, Wilske B: Comparison of in vitro and in vivo activity of
various antibiotics against Borrelia burgdorferi. Poster Stockholm 1990.
(68) Preac-Mursic V et al: Survival of Borrelia burgdorferi in antibiotically
treated patients with Lyme Borreliosis. Infection 17 (1989) 355-359
(69) Maiwald M, Stockinger C, Hassler D, von Knebel-Doeberitz M, Sonntag HG:
Evaluation of the detection of Borrelia burgdorferi DNA in urine samples by
polymerase chain reaction. Infection 23 (3) (1995) 173-9
7.3 Postskriptum: Das "Allerletzte" zum Thema
(70) Omura Y, Beckman, SL (Heart Disease Research Foundation, New York, USA: Application of intensified (+) Qi Gong energy, (-) electrical field, (S) magnetic field, electrical pulses (1-2 pulses/sec), strong Shiatsu massage or acupuncture on the accurate organ representation areas of the hands to improve circulation and enhance drug uptake in pathological organs: Clinical applications with special emphasis on the "Chlamydia-(Lyme)-uric acid syndrome" and "Chlamydia-(cytomegalovirus)-uric acid syndrome". Acupuncture and Electrotherapeutics Research. 20 (1) (1995) 21-72